
咨询热线:
17701648843
基因治疗是指通过修复致病基因,或者导入正确基因而达到治疗效果的手段。通常分为两大类:ex vivo和in vivo。Ex vivo指在体外完成细胞遗传操作修复,再将修复后的细胞输入到人体;而in vivo指将递送载体输入到人体,在体内完成细胞修复。罕见病通常为单基因病,是最适合使用基因治疗攻克的疾病。相比于其他药物,基因治疗的优势在于从源头上解决问题,理论上通过一次或数次治疗即可攻克疾病。其中AAV递送系统是现今基因治疗所采用的主流载体。
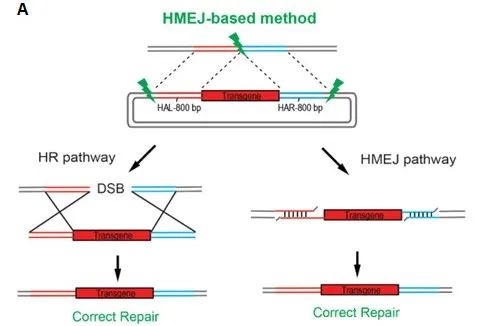
图二 HMEJ介导修复方式[7]
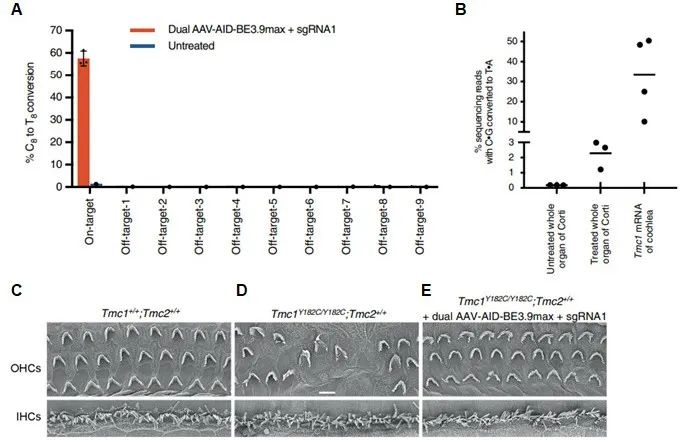
研究者在体外细胞测试sgRNA编辑效率,选择效率最高的sgRNA用于体内基因治疗实验,并选择AAV9和AAV-PHP.eB进行基因递送。将SaCas9-KKH和sgRNA+donor分别装载在两个AAVs中,经检测发现双AAVs递送系统体外细胞测试的正确编辑效率高达17.8%,并且几乎没有脱靶(图三A)。在出生1天的Klhl18lowf纯合小鼠的内耳中注射双AAVs,14天后检测到整个耳蜗的基因组DNA成功编辑效率为0.1%,10周后可提高到0.32%(图三B)。相关研究表明Klhl18的缺失会导致IHCs变得尖细,但OHCs不受影响[4]。从扫描电镜图片观察到,基因治疗后8周龄小鼠的IHCs细胞形态与野生型相比恢复正常(图三C)。
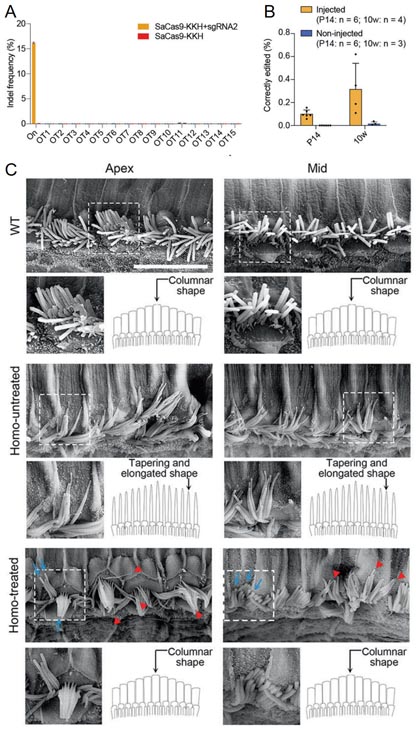
图三 双AAVs递送CRISPR/Cas9-HMEJ修复的隐性耳聋小鼠基因治疗效果[3]
综上所述,利用AAV递送工具进行基因治疗,可在体修复部分常染色体隐性耳聋小鼠模型的单基因突变,恢复小鼠部分听力。不同基因编辑工具的DNA修复效率有所不同,可根据具体基因突变位点的属性来选择最佳修复工具。针对AAV载体容量受限问题,可将基因编辑工具拆分并利用双AAVs系统进行递送。尽管双AAVs递送会降低编辑效率,但在小鼠体内实验结果已经证明疗效明显。随着这些基因治疗系统的不断更新,未来还可拓宽应用到其他罕见病的研究以及转化治疗上。
参考文献
1. Carpena NT, Min YL: Genetic Hearing Loss and Gene Therapy. Genomics & Informatics 2018, 16(4):e20.
2. Yeh WH, Shubina-Oleinik O, Levy JM, Pan B, Liu DR: In vivo base editing restores sensory transduction and transiently improves auditory function in a mouse model of recessive deafness. Science translational medicine 2020, 12(546):eaay9101.
3. Gu X, Hu X, Wang D, Xu Z, Wang F, Li D, Li G-l, Yang H, Li H, Zuo E et al: Treatment of autosomal recessive hearing loss via in vivo CRISPR/Cas9-mediated optimized homology-directed repair in mice. Cell Research 2022,0:1-4.
4. Ingham NJ, Banafshe N, Panganiban CH, Crunden JL, Steel KP: Inner hair cell dysfunction in Klhl18 mutant mice leads to low frequency progressive hearing loss. PLoS ONE 2021, 16(10):e0258158.
5. Cox D, Platt RJ, Zhang F: Therapeutic genome editing: prospects and challenges. Nature Medicine 2015,21(2):121-131.
6. Yang Y, Wang L, Bell P, Mcmenamin D, He Z, White J, Yu H, Xu C, Morizono H, Musunuru K: A dual AAV system enables the Cas9-mediated correction of a metabolic liver disease in newborn mice. Nature Biotechnology 2016,34(3):334-338.
7. Yao X, Wang X, Hu X, Liu Z, Yang H: Homology-mediated end joining-based targeted integration using CRISPR/Cas9. Cell Research 2017, 27(6):801-814.